Bioquímica: Composición, Enlaces y Propiedades del Agua
- La Bioquímica se encarga de estudiar la composición química de los seres vivos, las
relaciones entre dichos materiales, sus transformaciones, la regulación y funcionamiento de
estos procesos y, por lo tanto, las repercusiones que tiene en la fisiología de los organismos. - Las Biomoléculas Orgánicas, están formadas por seis elementos fundamentales, carbono,
hidrógeno, oxígeno, nitrógeno, fósforo y azufre. principales iones: sodio, potasio, cloro, magnesio, calcio - Electronegatividad: Es la atracción de un átomo de una molécula de aceptar electrones o
su resistencia a perderlos. - Diferencia entre cero y 0.4 = enlace covalente no polar.
Diferencia mayor a 0.5 y menor a 1.6 = enlace covalente polar.
Diferencia entre 1.7 y 3.3 = enlace iónico - Enlace Covalente no polar: Se forma entre átomos de una misma clase, hidrógeno (H2) nitrógeno (N2), oxígeno (O2), cloro (Cl2)
- Enlace Covalente polar: Está formado entre átomos de elementos distintos: no comparten
por igual el par de electrones debido a que existe una diferencia de electronegatividad. - Enlace covalente coordinado: átomos o iones con pares de electrones libres
Enlace Iónico:entre átomos con diferencias significativas en la electronegatividad, lo que resulta en la transferencia de electrones de un átomo a otro.
- se vieron ejemplos de solubilidad, entre el agua, aceite y jabón, en el primer vaso se observó una separación de fases después de dejarlas reposar, eso se debió a la miscibilidad entre el agua(polar) y el aceite ( no polar); en le segundo experimento al agregar jabón a la mezcla de agua y aceite siendo un emulsionante donde el aceite quedó separado, después de 24 hrs de reposo la mezcla se volvió más estable y se observó las separaciones siendo el agua la más soluble y quedándose al fondo, seguida del jabón y el aceite al final
- la energía se define como la capacidad para realizar un trabajo
- la termodinámica es la ciencia que estudia la propagación del calor
- exotérmicas:a las reacciones que liberan energía
- endotérmicas: absorben energía
0. ley: Si dos sistemas están cada uno en equilibrio térmico con un tercer sistema, entonces están en equilibrio térmico entre sí.
- ley: la energía total de un sistema más la del entorno permanece constant” ley de conservación de la energí”, la energía no se crea ni se destruye solo se transforma
- ley: un sistema aislado, la entropía o grado de desorden tienden a aumentar hacia un valor máximo cuando se aproxima al equilibrio verdadero
- ley: A medida que la temperatura de un sistema se acerca al cero absoluto, la entropía del sistema tiende a un valor mínimo constante.
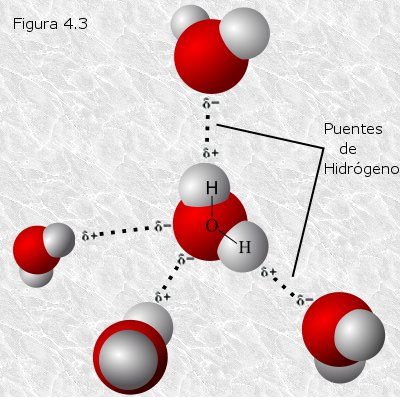
Para que se forme un puente de hidrógeno es necesaria la presencia de un átomo de hidrógeno (H) unido covalentemente a un átomo electronegativo (habitualmente el O y N) que, debido a su carga parcial positiva, será atraído por otro átomo electronegativo presente en una molécula diferente.
- Ionización del agua. La capacidad del agua para ionizarse es limitada, pero esencial para los organismos vivos. El agua puede actuar como un ácido si cede un protón (ión hidrógeno, H+) y con la formación del ión hidróxido, OH−); su ionización o disociación puede representarse con la siguiente reacción.
- Solvente universal. Al agua se le identifica como el solvente universal, debido a su capacidad de disolver más sustancias y en mayor cantidad que cualquier otro solvente.
- Elevado calor específico. El calor específico es el calor necesario para elevar la temperatura de 1g de líquido a 1°C.
- Elevado calor de vaporización.El organismo humano pierde continuamente agua por la piel y los pulmones, y el alto calor de vaporización permite mantener la temperatura del cuerpo más baja que la del ambiente cuando éste es caluroso.
- Elevada conductividad térmica. Esta propiedad permite regular la temperatura del organismo humano conduciendo el calor entre las diferentes partes del mismo e igualando y manteniendo la temperatura.
- Hidrólisis. Ésta es la reacción química en la que interviene una molécula de agua que reacciona con otra molécula diferente.
- Polaridad del agua. La atracción electrostática de iones (del globo) al acercarse a las moléculas del agua estas se atraen con las cargas parciales positivas y negativas del agua.
- desequilibrios hídricos:se refiere a una situación en la que hay una alteración en el equilibrio de líquidos en el cuerpo, especialmente en lo que respecta al agua.
- El agua se encuentra distribuida en el intracelular (30-40% del peso corporal total) y el extracelular que incluye el plasma (4.5%) y el líquido intersticial (15%).
- Un Electrolito es toda sustancia que en solución acuosa tiene la capacidad de conducir la corriente eléctrica.
• Electrolitos fuertes: Son aquellos que se disocian en gran proporción, existen casi exclusivamente en forma de iones en solución acuosa y son buenos conductores de corriente eléctrica. En este grupo se encuentras los ácidos y bases fuertes, así como sus sales.
• Electrólitos débiles. Son aquellos que se ionizan en menor proporción, existen como una mezcla en un equilibrio de iones y moléculas y conducen menos la corriente eléctrica. En este grupo se encuentran los ácidos y bases débiles, así como sus sales.
• No Electrolitos. Son aquellos compuestos que no se ionizan, solamente se disuelven como moléculas, y por ende, dan soluciones que no conducen la corriente eléctrica. En este grupo se encuentran sustancias como la glucosa, sacarosa y solventes orgánicos no polares.
